Les sondes de défibrillation permettent de délivrer un signal électrique lorsqu’une anomalie du rythme cardiaque est détectée et ainsi permettre au cœur de battre normalement ;
Environ 227 000 sondes de défibrillation Riata et Riata ST avec isolant en silicone ont été mise sur le marché en 2001 puis implantées dans le monde, en France 6198 sont utilisées depuis 2002. Elles sont disponibles en deux diamètres différents (7 French et 8 French).
Un défaut a été constaté sur ces sondes, celui d’une externalisation du conducteur suite à l’abrasion de l’isolant qui entoure le corps de la sonde. Le phénomène ne s’accompagne d’aucun accident dans 80 % des cas. Dans les 20 % restants, le risque de chocs inappropriés doit être pris en compte car pouvant entraîner le décès des patients. Enfin, cette proportion de 20 % est susceptible d’augmenter.
Le taux d’abrasion observé par la société St Jude Médical en décembre 2010 était de 0,47 % après 9 années de commercialisation. Ce dernier est passé à 0,63 % en décembre 2011 ;
Une étude néerlandaise, a confirmé le risque de défaillance des sondes de défibrillation Riata et Riata ST avec isolant en silicone fabriquées par « St Jude Médical France ». Elle a montré que les données du fabricant étaient sous-estimées et faisait état de 15% de cas d’externalisation des conducteurs observés dans un centre d’Irlande du Nord pour l’ensemble des patients ;
Au vu de ces données et en complément des recommandations données par St. Jude, dans le cadre du suivi des patients, l’Afssaps a publié des recommandations de suivi des patients porteurs de ces sondes.
Actuellement, les sondes Riata et Riata ST ne sont plus commercialisées depuis fin 2010 au niveau mondial.
En France, les dernières sondes Riata 8 French ont été commercialisées en 2008 et en 2010 pour les Riata 7 French. Elles ont été remplacées par les sondes Riata « Optim » et les sondes DURATA dont l’isolant est un matériau différent. Quelques cas d’abrasion ont été rapportés avec ses sondes. Elles nécessitent de ce fait, d’être dotées d’un boîtier performant qui puisse surveiller l’intégrité de la sonde et détecter la moindre anomalie (lead integrity alarm), ceci, afin d’éviter la mise en jeu du pronostic vital du patient.
Source :
- Afssaps, point d’information, 12 Mars 2012
- http://blog.santelog.com/2012/03/18/defibrillation-des-sondes-avec-isolant-en-silicone-sous-surveillance-afssaps/
- http://fr.wikipedia.org/wiki/Stimulateur_cardiaque
En Algérie, ces sondes ont été déjà implantées par certains centres à travers le territoire et nous recommandons une surveillance rigoureuse des patients porteurs de ce matériel. CNPM le, 10 juillet 2012
Dernière Mise à jour : Mars 2017
Parmi les moyens de contraception très efficaces, le dispositif intra-utérin au lévonorgestrel est une alternative aux dispositifs intra-utérins au cuivre. Il est commercialisé pour la contraception intra-utérine et pour les ménorragies fonctionnelles (1).
Son dossier d’évaluation clinique initial a montré une efficacité contraceptive au moins égale à celle des stérilets au cuivre, avec moins de ménorragies sous Mirena que sous stérilet au cuivre.
Le profil des effets indésirables du dispositif intra-utérin au lévonorgestrel Mirena est constitué principalement de :
–Saignements prolongés et irréguliers qui apparaissent durant les 90 premiers jours après l’insertion de MIRENA, respectivement chez 22 % et 67 % des utilisatrices ; ces taux diminuent pour atteindre 3 % et 19 % respectivement, à la fin de la première année.
-Une aménorrhée et une oligoménorrhée apparaissent respectivement dans 0 % et 11 % des cas au cours des 90 premiers jours, augmentant respectivement à 16 % et 57 % à la fin de la première année d’utilisation (3).
Néanmoins, la plupart des effets indésirables sont bien tolérés par les utilisatrices. Les notifications d’arthralgies, érythème noueux, psoriasis, hypertensions intracrâniennes et syndromes de canal carpien ont valeur de signaux à explorer (4).
En pratique: un dispositif intra-utérin contenant du lévonorgestrel est une alternative quand un dispositif au cuivre est mal toléré en raison de saignements menstruels abondants, il semble être particulièrement utile pour réduire la perte de sang menstruel (5).Toutefois, son évaluation clinique versus progestatifs oraux mérite d’être poursuivie (6).
Références :
(1) Revue Prescrire / Tome 34, N° 364, février 2014 ;
(2) Revue Prescrire / Tome 26, N° 273, juin 2006 ;
(3) RCP/ANSM, mis à jour le 23/02/2017 ;
(4) Revue Prescrire / Tome 38, N° 415, Mai 2018 ;
(5) Martindal, 38ème edition, 2014, page 2296 ;
(6) Martindale, 34ème edition, 2005, page 1567.
Dernière mise à jour : Mars 2019
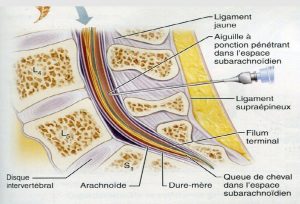
La rachianesthésie estune technique d’anesthésie loco-régionale fréquemment utilisée en chirurgie, elle consiste à injecter un anesthésique local dans le liquide céphalorachidien (LCR) à travers l’espace intervertébral.
Le médicament anesthésiquevaagirlocalement sur les racines nerveuses médullaires (1).
Des céphalées peuvent survenir après une rachianesthésie appelées céphalées post-rachianesthésie(CPR). C’est une complication fréquente de la rachianesthésie et leur incidence varie entre 4,2 % et 11 % (2).
Physiopathologie des céphalées post-rachianesthésie :
La rachianesthésie peut être réalisée chez le patient en position assise ou en décubitus latéral.Après la désinfection du dos, on réalise d’abord une anesthésie locale de la peau avant de faire le geste puis on utilise une aiguille extrêmement fine, dont la pointe n’est pas traumatique pour les tissus et l’introduire entre deux vertèbres lombaires en dessous de la terminaison de la moelle épinière (1). Untel geste peut entrainer une perte de LCR dans l’espace péridural par le trou dural (brèche créée par l’introduction de l’aiguille) provoquant une chute de la pression du LCR et une hypotension intracrânienne.
La diminution du liquide céphalo-rachidien intracrânien entraine une traction sur les structures sensibles de la douleur et une augmentation du débit sanguin cérébral responsables des CPR (4).
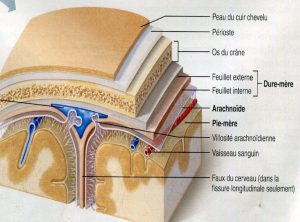
Il existe différents types d’aiguilles,
- Les aiguilles de Quincke,
- Les aiguilles de Sprotte,
- Les aiguilles de Withacre.
Les aiguilles de Quincke sont perforées à leur extrémité qui est taillée en biseau.
Les aiguilles de Sprotte et de Withacre ont une pointe non tranchante (en pointe de crayon) et l’orifice est situé tout près de l’extrémité, ces dernières aiguilles sont qualifiées d’«atraumatique».
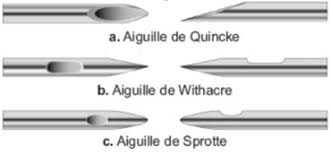
Ces caractéristiques jouent un rôle non négligeable dans la survenue des céphalées post-rachianesthésie. Ainsi, utiliser des aiguilles de rachianesthésie de petit diamètre et atraumatique entraine une diminution significative de l’incidence des CPR car la brèche est de plus petite taille (petite fuite de LCR) et les fibres constituant la dure mère sont séparées plutôt que sectionnées (5).
Caractéristiques cliniques des céphalées post-rachianesthésie :
Les céphalées post-rachianesthésie se développent dans les jours qui suivent le geste chirurgical. Elles sont caractérisées par :
- Leur intensité : les céphalées sont souvent intenses
- Leur caractère postural : elles s’aggravent en position assise et s’atténuent en position couchée
- Des douleurs cervicales peuvent être associées
- Une photophobie (6).
Les facteurs de risque reconnus des céphalées post-rachianesthésie sont : le sexe féminin, le jeune âge (20-30 ans), une faible masse corporelle, les aiguilles de large diamètre, lenombre d’essais pour localiser l’espace rachidien ou l’espace péridural expérience de l’opérateur.
Par contre, ni l’orientation du biseau de l’aiguille, ni la technique utilisée (abord médian ou para-médian) ne semblent influencer l’incidence des céphalées (5).
Diagnostic des céphalées post-rachianesthésie :
Le diagnostic des céphalées post rachianesthésie (CPR) est basé sur l’interrogatoire à la recherche d’une ponction durale documentée et une céphalée posturale sévère.
Un patient présentant des caractéristiques atypiques et inattendues de CPR graves nécessite une évaluation neurologique complète et un bilan radiologique (TDM, IRM) (4).
Le diagnostic différentiel de CPR comprend le sevrage de la caféine, les migraines, la méningite, la sinusite, la pré-éclampsie, la pneumocéphalie et les pathologies intracrâniennes telles qu’un hématome sous-dural et le syndrome d’encéphalopathie postérieure réversible (SEPR).
Traitement des céphalées post rachianesthésie :
- Mesures conservatrices :
La prise en charge conservatrice sous forme de thérapie de soutien comprend le repos au lit et la réhydratation. Ce traitement peut contrôler les symptômes mais n’apporte généralement pas un soulagement complet.
L’alitement, le décubitus dorsal et les ceintures abdominales peuvent n’avoir aucun avantage ou ne pas être pratiques dans le cadre d’une parturiente s’occupant d’un nouveau-né, et l’alitement prolongé n’est pas recommandé car il peut augmenter le risque de complications thromboemboliques (4).
- Traitement pharmacologique :
Les vasoconstricteurs cérébraux sont utilisés pour réduire les céphalées (exemple de la caféine) par leur effet sur les vaisseaux sanguins cérébraux dilatés.
La caféine orale est recommandée à la dose de 300 à 500 mg une ou deux fois par jour avec un maximum de 900 mg en 24 heures. La caféine intraveineuse peut être administrée si le patient est incapable de boire (4).
Les analgésiques (anti-inflammatoires non stéroïdiens tels que l’aspirine, l’acétaminophène et opioïdes oraux comme l’oxycodone) sont aussi indiqués pendant les premières heures.
D’autres médicaments sont utilisés avec des preuves d’efficacité insuffisantes, il s’agit de l’aminophylline, la théophylline, l’hormone adrénocorticotrope (ACTH), la desmopressine, l’hydrocortisone, la dexaméthasone, la méthylprednisolone, les triptans, les gabapentinoïdes, la méthylergonovine, l’ondansétron, le mannitol, la néostigmine et l’atropine (4).
- Traitement invasif : Blood Patch (BP).
Le traitement définitif des céphalées et/ou des troubles associés repose sur la réalisation d’un Blood Patch (BP) ou injection péridurale de sang autologue. La réalisation d’un BP est simple, il s’agit d’une injection péridurale de sang autologue, parfois désignée sous le terme de colmatage péridural, il est effectué dans des conditions strictes d’asepsie après repérage de l’espace péridural (7).
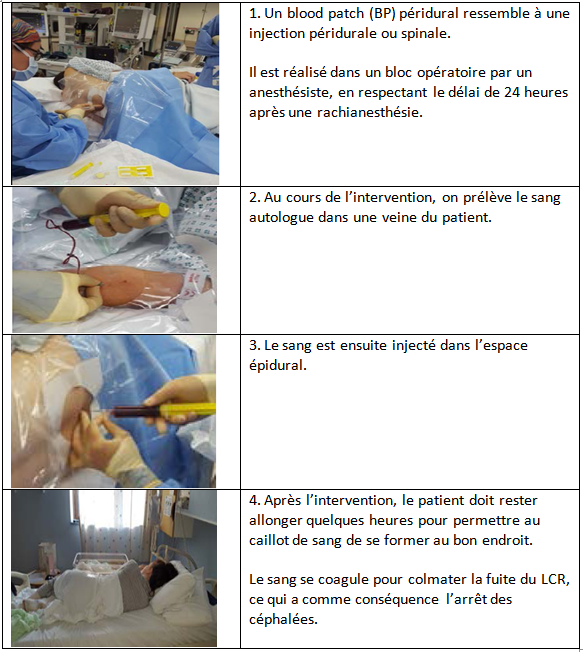
Lorsque la ponction durale est récente et le point de pénétration cutané est toujours visible et/ou lorsque l’étage intervertébral de ponction est connu, il est de bonne règle de pratiquer le BP au même niveau, voire au-dessous du niveau de la brèche. Lorsque de multiples ponctions ou tentatives de ponction ont eu lieu, il est préférable d’injecter le sang au niveau ponctionné le plus bas (7).
Contre-indications du Blood Patch :
Les contre-indications du Blood Patch sont rares, elles relèvent soit d’une contre-indication habituelle à l’abord péridural (troubles de l’hémostase), soit d’une contre-indication à l’injection de sang autologue (bactériémie, virémie).
Le refus du patient, qui doit avoir reçu une information adaptée, claire et loyale sur le BP, est une contre-indication formelle.
Il est également important, avant de réaliser un BP, d’éliminer les diagnostics différentiels qui sont la thrombose des veines corticales et la méningite. Au moindre doute, il faut avoir recours à l’imagerie médicale encéphalique et/ou lombaire afin d’affirmer le diagnostic (7).
Conclusion :
Les céphalées post-rachianesthésie sont fréquentes et peuvent être sévères. L’utilisation d’une aiguille atraumatique et de petit diamètre entraine une diminution significative de l’incidence des CPR. Leur prise en charge doit être rapide et efficace. Le traitement pharmacologique peut soulager le patient mais le recours aux techniques invasives tel que le Blood Patch s’avère parfois nécessaire.
Référence :
- Xavier P. « L’anesthésie loco-régionale : la rachianesthésie » » Chirurgynécol.Mam. de Charente. http://www.chirurgie-gynecologie.fr/page-anesthesie/anesthesie-locoregionale.html. Mise à jour le 15 Aout 2015.
- Nath S. et coll. ̎Atraumatic versus conventional lumbar puncture needles: a systematic review and meta-analysis ̎. The Lancet 2018. 391 :1197-204.
- Aubrun F. « Céphalées post-anesthésie » Le praticien en anesthésie-réanimation. 2004 ;8, Issue 3 : 183-191.
- Comité d’anesthésie obstétricale ̎Statement on Post-Dural PunctureHeadacheManagement ̎.Am Soc Anesthesiol 2021: https://www.asahq.org › files › standards-guidelines: 10 pages.
- Lenelle L. et coll. « Les céphalées post-ponction durale : traitement et prévention »Rev. Med. Liège 2011,66 : 11 : 575-580.
- Association d’anesthésie obstétricale « Maux de tête après une anesthésie péridurale ou une rachianesthésie ‒ ce qu’il faut savoir ? » Obstetanesthesistesassoc. 2016, http://www.labourpains.com: 05 pages.
- Viel E. et coll. « Céphalées positionnelles après anesthésie ou infiltration péridurale, rachianesthésie ou ponction lombaire : que faire ? »Correspondances en médecine – 4, (III) 2002. http://www.edimark.fr › Front › frontpost › getfiles : 04 pages.
Dernière mise à jour : Mars 2025